Sommaire
Résumé
- En 2026, le CBD est un Novel Food non autorisé dans l’UE. L’EFSA a établi une dose provisoire de sécurité fixée à 0,0275 mg/kg de poids corporel par jour (soit environ 2 mg/jour pour un adulte de 70 kg), applicable uniquement aux isolats de CBD ≥ 98 % de pureté.
- L’EFSA juge les données de sécurité insuffisantes, notamment sur le foie et la reproduction.
- En France, la DGCCRF poursuit ses contrôles et l’ANSES alerte sur les risques toxicologiques.
- Le Royaume-Uni applique un régime transitoire plus pragmatique, qui limite les doses et surveille les produits listés.
Le CBD, une molécule sous surveillance
En Europe, le marché du CBD a dépassé 2,6 milliards d’euros en 2024, selon le cabinet Prohibition Partners. Environ 15 % des adultes européens déclarent avoir déjà consommé un produit contenant du cannabidiol, principalement sous forme d’huile, de complément alimentaire ou de boisson relaxante.
Le cannabidiol, ou CBD, est l’un des plus de 100 cannabinoïdes identifiés dans le chanvre. Contrairement au THC, il n’a pas d’effet psychotrope. Plusieurs études précliniques suggèrent des effets potentiels sur la relaxation, le sommeil ou la gestion de la douleur, mais aucune allégation de santé n’est aujourd’hui autorisée par la Commission européenne.
Derrière ce succès commercial se cache pourtant un cadre juridique strict. En Europe, les produits contenant du CBD destinés à être ingérés (gélules, huiles sublinguales, boissons, aliments) relèvent du règlement (UE) 2015/2283 sur les aliments nouveaux, appelé “Novel Food”. [1]
Qu’est-ce qu’un “Novel Food” ?
Le règlement (UE) 2015/2283 définit comme « aliment nouveau » toute substance ou ingrédient n’ayant pas été consommé de manière significative avant mai 1997 dans l’Union européenne.
Avant toute mise sur le marché, un Novel Food doit obtenir une autorisation de la Commission européenne, fondée sur une évaluation de sécurité réalisée par l’Autorité européenne de sécurité des aliments (EFSA).
Cette procédure implique un dossier scientifique complet : données toxicologiques, composition, stabilité, exposition estimée, interactions médicamenteuses, etc. L’objectif : garantir que le nouvel aliment est sûr pour la santé humaine.
Le CBD classé comme Novel Food
Le Catalogue des Novel Foods de la Commission européenne indique que : “Les extraits de Cannabis sativa L. et les produits dérivés contenant du cannabidiol (CBD) sont considérés comme des aliments nouveaux, dans la mesure où l’historique de consommation de ces extraits n’a pas été démontré avant 1997.” [6]. En d’autres termes, tous les produits alimentaires qui contiennent du CBD isolé, purifié ou extrait (compléments, boissons, confiseries, huiles ingérables) sont soumis à autorisation préalable avant leur commercialisation dans l’UE. Le seul cas non concerné : les graines, farines ou huiles de chanvre traditionnelles, utilisées depuis des siècles et donc considérées comme « non nouvelles ».
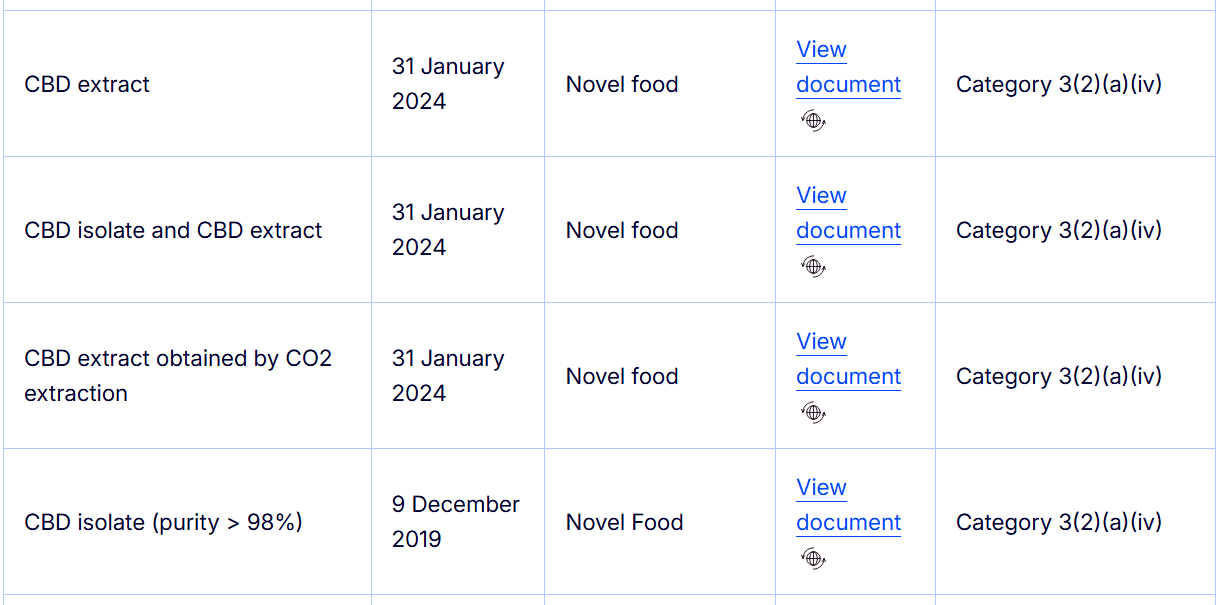
Source : https://food.ec.europa.eu/food-safety/novel-food/consultation-process-novel-food-status_en
Pas d’autorisation Novel Food pour le CBD à ce jour
Malgré plusieurs demandes d’autorisation déposées depuis 2019, aucun produit à base de CBD n’a encore obtenu de validation européenne au titre du règlement (UE) 2015/2283. En 2022, l’Autorité européenne de sécurité des aliments (EFSA) avait suspendu l’examen des dossiers, estimant que les données disponibles étaient insuffisantes pour établir la sécurité du cannabidiol comme aliment. Les principales préoccupations concernaient :
- Les effets sur le foie et le système gastro-intestinal ;
- Les impacts sur le système nerveux et le comportement ;
- Les risques potentiels pour la reproduction et le développement ;
- Les interactions médicamenteuses, notamment via les enzymes hépatiques (CYP450) ;
- Les incertitudes relatives à l’exposition chronique et aux effets à long terme. [2].
Depuis, de nouvelles données ont été examinées par l’EFSA. En 2026, plus de 200 demandes d’autorisation avaient été soumises à la Commission européenne, dont 17 dossiers en cours d’évaluation scientifique par l’EFSA.
Préoccupations sur les risques hépatiques
Malgré la fixation d’une dose provisoire en décembre 2025, l’EFSA considère que la sécurité du CBD ne peut toujours pas être établie, en particulier en raison du signal hépatique observé dans les études récentes. Une étude menée en 2025 chez 201 adultes sains recevant environ 5 mg/kg/jour de CBD (≈ 300–400 mg/jour) pendant 28 jours a montré :
- des élévations d’ALT ou AST > 3× la limite supérieure de la normale chez 5 à 7 % des participants ;
- plusieurs cas répondant aux critères de lésion hépatique médicamenteuse (DILI) ;
- une éosinophilie associée, compatible avec un mécanisme immunologique.
Les anomalies sont apparues après environ trois semaines et ont régressé à l’arrêt du traitement. La durée limitée de l’étude ne permet pas d’exclure un risque en cas d’exposition prolongée. Un risque majoré d’élévation des enzymes hépatiques est également documenté en cas d’association avec certains médicaments, notamment le valproate et d’autres antiépileptiques. Des incertitudes persistent par ailleurs concernant les effets endocriniens, reproductifs et les interactions médicamenteuses.
Une dose provisoire fixée par l’EFSA en décembre 2025
En décembre 2025, l’EFSA a réalisé une modélisation toxicologique (Benchmark Dose) à partir d’études subchroniques conformes aux Bonnes Pratiques de Laboratoire. En appliquant un facteur d’incertitude de 400, elle a fixé une dose provisoirement sûre à 0,0275 mg/kg/jour. Cette valeur correspond à environ 2 mg/jour pour un adulte de 70 kg.
Cette dose ne concerne que les isolats de CBD d’une pureté ≥ 98 %, sans nanoparticules, et produits selon un procédé sécurisé excluant toute génotoxicité.
Effets endocriniens observés chez l’animal
Les évaluations récentes de l’EFSA mettent en évidence des effets endocriniens dans les études animales. Une diminution des concentrations de thyroxine (T4) a été observée dès 30 mg/kg/jour, avec des effets statistiquement significatifs à partir de 100 mg/kg/jour. Ces modifications s’accompagnaient, dans certaines études, d’une hypertrophie des cellules folliculaires de la thyroïde.
Des augmentations du poids des glandes surrénales et des modifications histopathologiques ont également été rapportées, de manière dose-dépendante, chez le rat.
À ce stade, les données humaines sont insuffisantes pour déterminer la pertinence clinique de ces observations, mais l’EFSA considère que ces éléments contribuent aux incertitudes persistantes sur la sécurité du CBD comme aliment. [4].
L’arrêt Kanavape : un tournant… mais pas une autorisation
Certains invoquent encore la célèbre affaire « Kanavape », jugée par la Cour de justice de l’Union européenne (CJUE) en novembre 2020. [7]
La Cour y a affirmé que le CBD extrait de l’ensemble de la plante de chanvre, non stupéfiant, ne peut pas être interdit à la commercialisation entre États membres au titre de la libre circulation des marchandises, sauf motif de santé publique justifié. Cependant, il faut bien comprendre que cet arrêt ne crée pas d’autorisation alimentaire. Il clarifie uniquement que le CBD n’est pas un stupéfiant au sens du droit européen et qu’il ne peut être discriminé commercialement. Autrement dit : la libre circulation reste conditionnée au respect du droit alimentaire, dont le règlement Novel Food.
Quelle est la situation en France ?
Les produits à ingérer sont interdits sans autorisation Novel Food
En France, la DGCCRF considère toujours que les produits contenant du CBD destinés à être ingérés (compléments, boissons, aliments) ne peuvent pas être commercialisés tant qu’ils ne disposent pas d’une autorisation Novel Food valide au niveau européen. [3].
Même si certaines entreprises invoquent un « cadre transitoire » ou des dépôts de dossiers auprès de l’EFSA, cela ne constitue pas une autorisation. La DGCCRF conserve la possibilité de suspendre la vente, de saisir ou de sanctionner les opérateurs non conformes.
Le seuil de THC ne doit pas dépasser 0,3 %
Depuis le décret de 2023, la France a harmonisé son seuil de THC à 0,3 % dans les variétés de chanvre autorisées, en cohérence avec le droit européen. Ce seuil ne change toutefois rien à la question du CBD alimentaire : un produit peut être sans THC, mais rester illégal s’il n’a pas d’autorisation Novel Food.
Les signaux de l’ANSES : vigilance toxicologique
En parallèle, l’Agence nationale de sécurité sanitaire (ANSES) a publié plusieurs avis appelant à la prudence. En 2023, elle a proposé de classer le CBD comme “présumé toxique pour la reproduction – catégorie 1B” selon le règlement européen CLP.
Cette position, encore en débat au niveau européen, pourrait conduire à de nouvelles restrictions pour les femmes enceintes, allaitantes ou sous traitement médicamenteux.
Les données examinées récemment par l’EFSA confirment ces préoccupations. Les études animales mettent en évidence des effets sur la fertilité et le développement : altération de la spermatogenèse dès 15 mg/kg/jour chez la souris, modifications des organes reproducteurs chez le rat et effets neurodéveloppementaux après exposition prénatale. Le passage transplacentaire du CBD a également été démontré dans les modèles animaux. Sur cette base, l’EFSA indique que la sécurité du CBD ne peut être établie pour les personnes de moins de 25 ans, ni pour les femmes enceintes ou allaitantes.
Le cas britannique : une régulation plus pragmatique
Depuis le Brexit, le Royaume-Uni applique son propre régime Novel Food, géré par la Food Standards Agency (FSA). Les autorités britanniques ont adopté une approche plus souple mais encadrée : les entreprises ayant déposé un dossier complet avant mars 2021 peuvent maintenir leurs produits sur le marché pendant l’examen. [5].
La FSA a publié une « Public List » recensant ces produits tolérés. Toutefois, cette liste ne vaut pas autorisation définitive ; elle sert simplement à encadrer temporairement le marché tout en attendant les conclusions de sécurité.
En 2026, la FSA recommande toujours :
- Une dose journalière maximale de 10 mg de CBD pour les adultes ;
- Un seuil de THC très bas : 0,07 mg par jour maximum ;
- Une information claire au consommateur sur les risques potentiels (somnolence, interactions médicamenteuses, atteintes hépatiques).
À titre de comparaison, la dose provisoire retenue par l’EFSA en décembre 2025 est plus basse que la recommandation britannique de 10 mg/jour.
Quelles sont les obligations réglementaires pour la commercialisation du CBD dans l’UE ?
Pour les entreprises qui souhaitent commercialiser du CBD dans l’Union européenne, plusieurs étapes sont nécessaires :
- Déterminer la catégorie du produit
Il faut d’abord identifier si le produit relève bien du champ alimentaire (complément, boisson, confiserie) ou cosmétique, voire pharmaceutique. Les cosmétiques au CBD relèvent du règlement (CE) 1223/2009 et du catalogue CosIng, un autre cadre juridique.
- Préparer un dossier Novel Food complet
Le dossier doit démontrer :
- la sécurité d’emploi du produit ;
- la composition et la pureté de l’extrait ;
- la traçabilité de la matière première ;
- les conditions d’utilisation et d’étiquetage.
Cette procédure est lourde : les coûts d’analyse et d’expertise se chiffrent souvent en centaines de milliers d’euros, et la durée d’instruction dépasse 18 à 24 mois.
- Surveiller la conformité en THC et contaminants
Même en dehors du cadre Novel Food, les produits au CBD doivent respecter les exigences du règlement (CE) 1881/2006 sur les contaminants (pesticides, métaux lourds, hydrocarbures aromatiques polycycliques) et le règlement (UE) 1169/2011 sur l’étiquetage. La conformité du THC total (< 0,3 %) doit être prouvée par des analyses en laboratoire.
- Attention aux revendications thérapeutiques
Toute mention suggérant un effet médical (anti-inflammatoire, anxiolytique, antidouleur, etc.) expose le fabricant à une requalification en médicament par les autorités sanitaires. Seules les indications autorisées dans le cadre de médicaments à base de cannabis (comme l’Epidyolex®) sont légales.
Quels sont les risques pour les consommateurs ?
Des produits non conformes
De nombreux produits vendus en ligne ou en boutique « bien-être » affichent des teneurs en CBD inexactes et parfois des traces de THC supérieures aux limites légales. Certains contiennent aussi des résidus de solvants ou de métaux lourds issus de procédés d’extraction mal maîtrisés.
Des données toxicologiques incomplètes
Les études disponibles montrent que le CBD peut influencer certaines fonctions physiologiques : métabolisme hépatique, régulation hormonale, vigilance, interactions médicamenteuses. À fortes doses, il peut provoquer somnolence, troubles digestifs, élévation des enzymes hépatiques ou altérations de la fertilité chez l’animal.
C’est pourquoi les autorités sanitaires préconisent :
- de limiter les doses (10 mg/jour au Royaume-Uni, précaution similaire envisagée dans l’UE)
- d’éviter la consommation pendant la grossesse ou sous traitement médical
- de choisir des produits analysés par des laboratoires accrédités.
Quelles sont les perspectives ?
En 2025, plusieurs acteurs européens — producteurs, associations, instituts de recherche — travaillent à fournir à l’EFSA les données manquantes sur la toxicologie du CBD.
Les discussions portent sur la mise en place d’un « cadre de tolérance transitoire » : il s’agirait d’autoriser temporairement les produits dont la sécurité est jugée plausible, tout en poursuivant la collecte de données scientifiques.
Mais rien n’est encore décidé. La Commission européenne reste très prudente, craignant d’autoriser un produit avant d’avoir évalué ses effets à long terme.
Article rédigé sur la base des positions officielles de la Commission européenne, de l’EFSA, de la DGCCRF, de l’ANSES et de la FSA britannique (mise à jour février 2026).
Sources
[1] https://eur-lex.europa.eu/eli/reg/2015/2283/oj
[2] https://www.efsa.europa.eu/en/topics/topic/cannabidiol
[3] https://www.economie.gouv.fr/dgccrf
[4] https://www.anses.fr/fr/content/cbd-et-sante
[5] https://www.food.gov.uk/business-guidance/cannabidiol-cbd
[6] https://eur-lex.europa.eu
[7] https://food.ec.europa.eu/food-safety/novel-food/novel-food-catalogue_en
